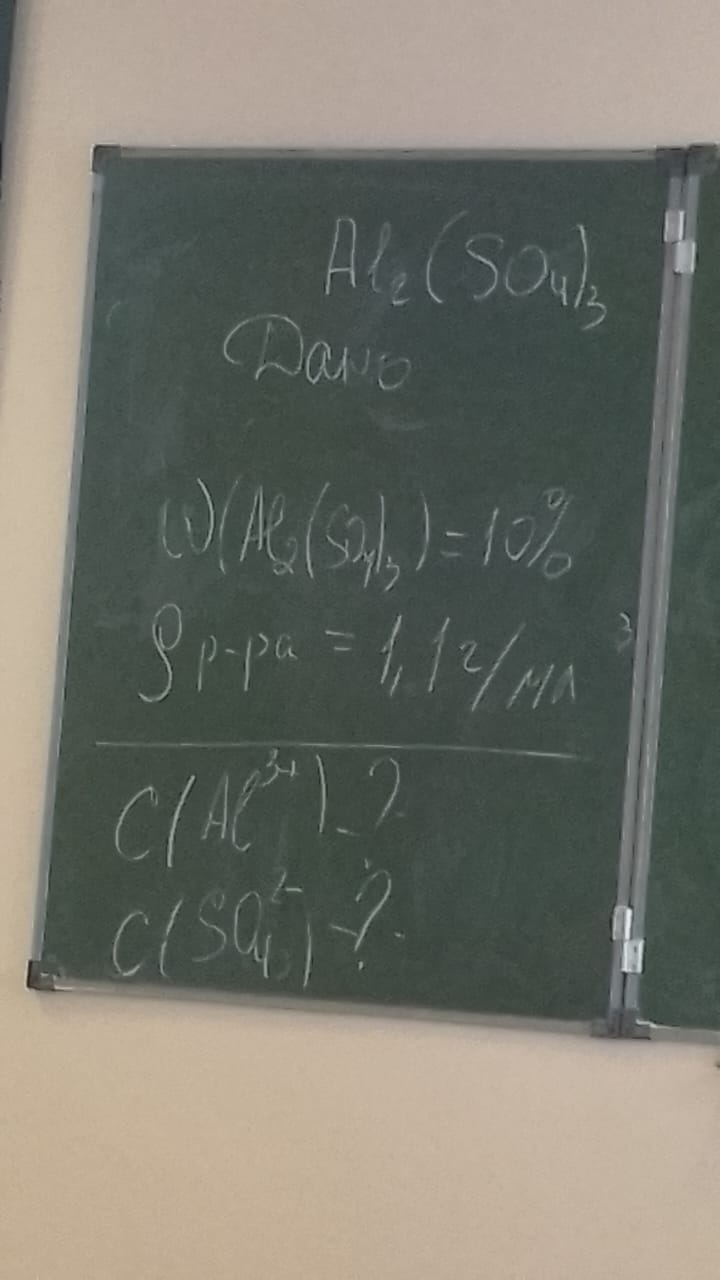Предмет: Химия
Раздел: Растворы, расчет концентраций, электролитическая диссоциация
На доске записана задача по расчету концентраций ионов в растворе сульфата алюминия:
Дано:
- Вещество: Al_2(SO_4)_3
- Массовая доля вещества: \omega(Al_2(SO_4)_3) = 10\%
- Плотность раствора: \rho = 1{,}12 \, \text{г/мл}
Найти:
- C(Al^{3+}) — молярная концентрация ионов алюминия
- C(SO_4^{2-}) — молярная концентрация сульфат-ионов
Шаг 1: Найдём молярную концентрацию Al_2(SO_4)_3
Для этого используем формулу:
C = \frac{\omega \cdot \rho \cdot 1000}{M}
Где:
- \omega = 0{,}10 (в долях)
- \rho = 1{,}12 \, \text{г/мл} = 1120 \, \text{г/л}
- M(Al_2(SO_4)_3) = 2 \cdot 27 + 3 \cdot (32 + 4 \cdot 16) = 54 + 3 \cdot 96 = 54 + 288 = 342 \, \text{г/моль}
Теперь подставим:
C(Al_2(SO_4)_3) = \frac{0{,}10 \cdot 1120}{342} \approx \frac{112}{342} \approx 0{,}327 \, \text{моль/л}
Шаг 2: Найдём концентрации ионов
Уравнение диссоциации:
Al_2(SO_4)_3 \rightarrow 2Al^{3+} + 3SO_4^{2-}
Отсюда:
- C(Al^{3+}) = 2 \cdot C(Al_2(SO_4)_3) = 2 \cdot 0{,}327 = 0{,}654 \, \text{моль/л}
- C(SO_4^{2-}) = 3 \cdot C(Al_2(SO_4)_3) = 3 \cdot 0{,}327 = 0{,}981 \, \text{моль/л}
Ответ:
- C(Al^{3+}) = 0{,}654 \, \text{моль/л}
- C(SO_4^{2-}) = 0{,}981 \, \text{моль/л}