Работа вам нужна срочно. Не волнуйтесь, уложимся!
- 22423 авторов готовы помочь тебе.
- 2402 онлайн
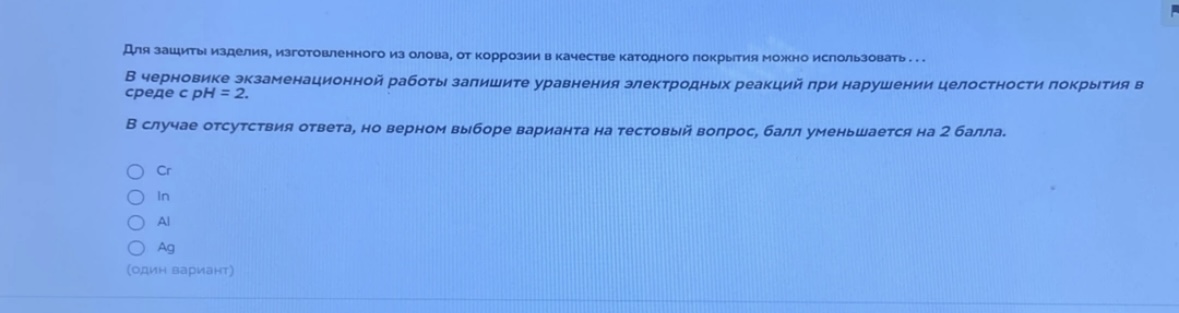
Для защиты изделия, изготовленного из олова, от коррозии в качестве катодного покрытия можно использовать... серновике экзаменационной работы запишите уравнения электродных реакций при нарушении целостности покрытия в среде с рН = 2.
Предмет: Химия
Раздел: Электрохимия, защита металлов от коррозии
Для защиты изделия из олова от коррозии в качестве катодного покрытия выбирают металл с более отрицательным электродным потенциалом, чем у олова. Это позволяет защитному металлу служить анодом, предотвращая коррозию олова.
Электродные потенциалы (стандартные значения):
Среди предложенных вариантов металл с более отрицательным потенциалом, чем у олова, — это хром (Cr), индий (In) и алюминий (Al). Однако алюминий имеет слишком низкий потенциал, что делает его менее подходящим из-за высокой активности. Лучший выбор — хром (Cr).
При повреждении покрытия защитный металл начинает окисляться, защищая олово. Рассмотрим реакции для хрома:
Cr \rightarrow Cr^{3+} + 3e^−
2H^+ + 2e^− \rightarrow H_2
Общая реакция коррозии: 2Cr + 6H^+ \rightarrow 2Cr^{3+} + 3H_2
Правильный выбор: Cr (хром).