Работа вам нужна срочно. Не волнуйтесь, уложимся!
- 22423 авторов готовы помочь тебе.
- 2402 онлайн
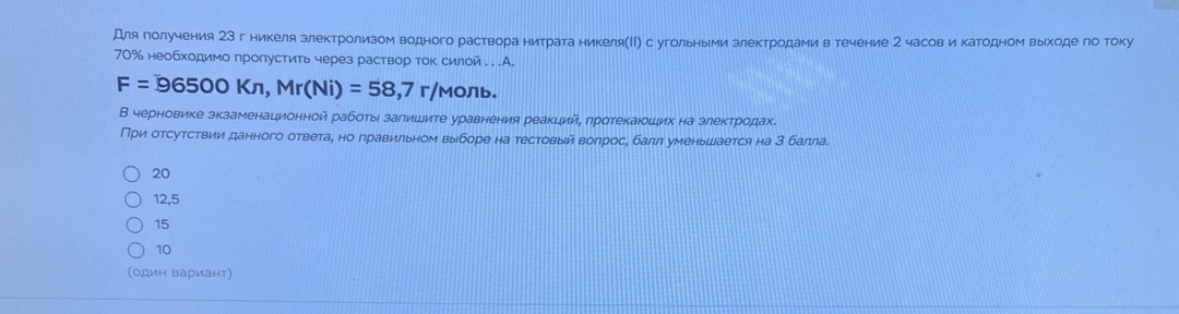
Для получения 23 г никеля электролизом водного раствора нитрата никеля(I) с угольными электродами в течение 2 часов и катодном выходе по току 70% необходимо пропустить через раствор ток силой ...А. F = 96500 Кл, Mr(Ni) = 58,7 г/моль.
Предмет: Химия
Раздел: Электрохимия
Для решения задачи воспользуемся законом Фарадея и формулой для расчёта массы вещества, выделившегося на электроде при электролизе.
При электролизе нитрата никеля (II) выделяется металл никель:
Ni^{2+} + 2e^- \rightarrow Ni
Для выделения 1 моля никеля требуется 2 Фарадея электричества.
Количество молей никеля, выделившегося на катоде:
n = \frac{m}{M_r} = \frac{23}{58,7} \approx 0,392 \, \text{моль}.
Для выделения 1 моля никеля требуется 2 Фарадея электричества, то есть:
Q_{\text{теор}} = n \cdot z \cdot F,
где z = 2 — количество электронов на один атом никеля.
Подставим:
Q_{\text{теор}} = 0,392 \cdot 2 \cdot 96500 \approx 75608 \, \text{Кл}.
С учётом катодного выхода \eta, реальный заряд:
Q_{\text{реальн}} = \frac{Q_{\text{теор}}}{\eta} = \frac{75608}{0,7} \approx 108011 \, \text{Кл}.
Сила тока рассчитывается по формуле:
I = \frac{Q}{t},
где t = 7200 \, \text{с}.
Подставим:
I = \frac{108011}{7200} \approx 15 \, \text{А}.
Для получения 23 г никеля необходимо пропустить ток силой 15 А.
Правильный ответ: 15.