Работа вам нужна срочно. Не волнуйтесь, уложимся!
- 22423 авторов готовы помочь тебе.
- 2402 онлайн
Каково давление азота, если его плотность равна 1,35 кг/м3, а средняя квадратичная скорость молекул 500 м/с?
Запишем для начала уравнение Клапейрона-Менделеева:

Поделим обе части уравнения на объем V, в правой части получившееся отношение m\V заменим на плотность газа ρ:

Среднюю квадратичную скорость молекул υкв определяют по такой формуле:

Выразим из выражения температуру газа T:

Это выражение подставим в формулу (1), тогда получим:

Задача решена в общем виде. Все величины, входящие в формулу, даны в единицах системы СИ, поэтому можно сразу посчитать ответ:
![]()
Ответ: 0,1 МПа.
В баллоне находится 20 моль газа. Сколько молекул газа находится в баллоне?
Известно, что в 1 моль любого вещества содержится число молекул, равное числу Авогадро NА. Тогда понятно, что в ν молях вещества содержится в ν раз больше, чем число Авогадро. Запишем сказанное в виде формулы:

Число Авогадро NА равно 6,022·1023 1/моль. Посчитаем численный ответ к задаче:

Поскольку в физике нет единицы измерения “штук”, то так и оставляем полученную величину безразмерной.
Ответ: 1,2·1025.
Сколько молекул кислорода находится в сосуде объемом 1 л, если температура кислорода 150° C, а давление равно 0,132 нПа?
Запишем формулу связи давления идеального газа p с концентрацией его молекул n и абсолютной температурой T:
![]()
В этой формуле k – постоянная Больцмана, она равна 1,38·10-23 Дж/К. Также запишем формулу определения концентрации n (по смыслу это количество молекул в единице объема):
![]()
Подставим последнее выражение в первую формулу, получим:
![]()
Осталось только выразить количество молекул N:

Переведем объем V в кубические метры, а температуру t – в Кельвины:

Считаем ответ:

Количество молекул в физике – безразмерная величина.
Ответ: 2,26·107.
Определить массу молекулы кислорода.
Рассмотрим ν (произвольное количество) моль кислорода. Напомним, что формула кислорода такая: O2.
Чтобы найти массу m некоторого количества кислорода, нужно молярную массу кислорода M умножить на число молей ν.
![]()
Используя таблицу Менделеева, легко определить, что молярная масса кислорода M равна 32 г/моль или 0,032 кг/моль. В одном моле содержится число Авогадро молекул NА, а в ν моль – в ν раз больше, то есть:
![]()
Чтобы найти массу одной молекулы m0, нужно всю массу m поделить на число молекул N.
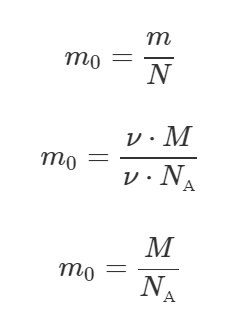
Число Авогадро NА – это табличная величина, равна 6,022·1023 моль-1. Произведем вычисления:

Ответ: 5,3·10-23 г.
Определить плотность воздуха при 27° C и давлении 0,1 МПа.
Запишем уравнение Клапейрона-Менделеева:
![]()
Плотность ρ – это масса единицы объема вещества, её находят как отношение массы вещества m к объему V:

Давайте разделим обе части уравнения Клапейрона-Менделеева на объем V:

Учитывая (1), имеем:

Из полученной формулы выразим плотность ρ:

Молярная масса воздуха M равна 0,029 кг/моль, универсальная газовая постоянная R – 8,31 Дж/(моль·К). Перед тем, как считать ответ, переведем температуру в шкалу абсолютных температур:

Ответ: 1,16 мг/см3.
Сколько молекул содержится в 5 кг кислорода?
Число молекул N находят как произведение количества вещества νν на число Авогадро NА (равное 6,022·1023 моль-1).
![]()
Количество вещества νν найдем как отношение массы mm к молярной массе вещества M (у кислорода O2 она равна 0,032 кг/моль).

В итоге имеем такую окончательную формулу:
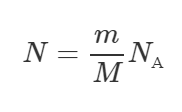
Посчитаем численный ответ к задаче:

Помните, что число молекул в физике – это безразмерная величина, не нужно писать никаких “штук”.
Ответ: 9,41·1025.
Какое давление на стенки сосуда производят молекулы газа, если масса газа 3 г, объем 0,5 л, а средняя квадратичная скорость его молекул 500 м/с?
Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:

Концентрацию молекул газа nn находят как отношение числа молекул N к объему газа V:

Тогда имеем:

Интересно, но произведение массы одной молекулы m0 на количество молекул N по смыслу есть масса газа m, поэтому:

Переведем массу m и объем V газа в систему СИ:

Произведем вычисления:

Ответ: 0,5 МПа.
При температуре 320 К средняя квадратичная скорость молекулы кислорода 500 м/с. Определить массу молекулы кислорода.
Решение:
Как и в механике, среднюю кинетическую энергию молекул кислорода можно определить по формуле:

С другой стороны, есть формула связи средней кинетической энергии с абсолютной температурой:

Приравняем правые части этих двух формул:

Выразим из этого равенства массу одной молекулы m0:

Напомним, что здесь k – это постоянная Больцмана, равная 1,38·10-23 Дж/К.
Посчитаем ответ:

Ответ: 5,3·10-23 г.
Вычислить среднюю квадратичную скорость молекул углекислого газа при температуре 223 К.
Среднюю квадратичную скорость молекул идеального газа υквυкв определяют по такой формуле:

В этой формуле R – универсальная газовая постоянная (R=8,31 Дж/(моль·К)), M – молярная масса газа, у углекислого газа CO2 равная 0,044 кг/моль. Все величины, входящие в формулу известны, посчитаем ответ:

Ответ: 0,36 км/с.
Определить давление водорода, если средняя квадратичная скорость его молекул равна 2550 м/с, а концентрация молекул 3,6·1025 м-3.
Воспользуемся основным уравнением молекулярно-кинетической теории (МКТ) идеального газа:

Как вы и сами можете видеть, нам неизвестна только масса одной молекулы m0, входящее в это уравнение. Её можно найти, поделив молярную массу газа M (а она у водорода равна 0,002 кг/моль) на число Авогадро NА (оно равно 6,022·1023 1/моль).

В итоге получается такая формула:

Произведем расчет ответа:

Ответ: 259 кПа.
Определить среднеквадратичную скорость молекул газа при давлении 100 кПа и плотности 1,25 кг/м3.
Запишем основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:

Вспомним формулу определения концентрации молекул n идеального газа:

Подставим это выражение в формулу (1), получим:

Произведение массы одной молекулы m0 на количество молекул N равно массе газа m, поэтому:

Отношение массы m к объему V – это физическая величина, называемая плотностью газа ρ, поэтому:

Осталось сделать последнее действие – выразить искомую скорость υкв:

Посчитаем численный ответ задачи:

Ответ: 0,49 км/с.
Какова средняя кинетическая энергия поступательного движения молекул газа, если при концентрации молекул 2,65·1025 м-3 давление равно 98,8 кПа?
Запишем основное уравнение МКТ идеального газа:
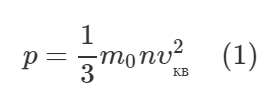
Среднюю кинетическую энергию молекул газа можно определить по формуле:

С учетом этой формулы, формула (1) примет такой вид:

Откуда искомая величина Eк равна:
![]()
Задача решена в общем виде, теперь посчитаем численный ответ:

В задачнике ответ дан не в Джоулях, а в электрон-Вольтах. Известно, что:
![]()
Поэтому:

Ответ: 0,035 эВ.
В баллоне емкостью 40 л находится 10 кг кислорода под давлением 20 МПа. Найти среднюю квадратичную скорость молекул кислорода.
Применим основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:

Распишем концентрацию молекул газа nn как отношение количества молекул N к объему газа V:

Произведение массы одной молекулы m0 на количество молекул N есть масса газа mm, поэтому:

Выразим искомую среднеквадратичную скорость υкв:

Переведем объем баллона в систему СИ и посчитаем ответ:

Ответ: 1763,6 км/ч.
Определить давление, при котором 1 м3 газа, имеющий температуру 60° C, содержит 2,4·1026 молекул.
Запишем формулу связи давления идеального газа с концентрацией молекул и абсолютной температурой:
![]()
В этой формуле n – концентрация молекул, которую легко определить по формуле:

Также в условии температура дана в Цельсиях. Чтобы перевести температуру в Кельвины, то есть в абсолютную шкалу, нужно воспользоваться формулой:
![]()
учетом всего записанного, формула (1) станет такой:
![]()
Здесь k – это постоянная Больцмана, равна 1,38·10-23 Дж/К. Посчитаем ответ:

Ответ: 1103 кПа.
Энергия поступательного движения, которой обладают все молекулы газа, находящегося в объеме 0,02 м3 при 17° C, составляет 0,66 Дж. Найти концентрацию молекул этого газа.
Кинетическая энергия поступательного движения одной молекулы идеального газа находят по формуле:

Постоянная Больцмана k равна 1,38·10-23 Дж/К. Умножим обе части этого равенства на число молекул газа N, тогда:

Произведение NEк по смыслу равна данной в условии энергии поступательного движения всех молекул газа E, поэтому:

Теперь поделим обе части равенства на объем V:

Отношение N\V в правой части есть концентрация молекул n:

Температуру t переведем в шкалу абсолютных температур:
![]()
Посчитаем ответ:

Ответ: 5,5·1021 м-3.
Сколько молекул содержится в 1 л воды?
Чтобы определить число молекул N, нужно количество вещества ν (число моль) умножить на число Авогадро NА:

Число Авогадро NА – это физическая постоянная, равная 6,022·1023 1/моль. Количества вещества ν можно найти, разделив массу m на молярную массу вещества M.
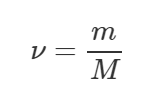
Молярная масса воды (H2O) равна 0,018 кг/моль. Ну и массу m можно найти как произведение плотности ρ на объем V:
![]()
Плотность воды ρ составляет 1000 кг/м3. В итоге Вы должны получить такую формулу:

Обязательно перед подстановкой в формулу переведем объем в единицы системы СИ:
![]()
Посчитаем ответ:

Ответ: 3,35·1025.
Найти концентрацию молекул газа, у которого средняя квадратичная скорость молекул равна 500 м/с при температуре 300 К. Плотность газа 0,27 кг/м3.
Запишем основное уравнение молекулярно-кинетической теории идеального газа:

Распишем в этой формуле концентрацию n как отношение числа молекул N к объему газа V:

По смыслу произведение m0N равно массе газа m, тогда:

Отношение массы газа m к объему газа V – это плотность газа ρ, поэтому:

Также запишем формулу связи давления идеального газа p с концентрацией молекул газа n и абсолютной температурой T:

Приравняем формулы (1) и (2), далее выразим искомую концентрацию n:

Произведем вычисления:

Ответ: 5,43·1024 м-3.
Какое значение температуры по шкале Кельвина соответствует температуре 100° C?
Чтобы перевести температуру из шкалы Цельсия в шкалу Кельвина (то есть в абсолютную шкалу температур), нужно воспользоваться следующей формулой:
T=t+273
Учитывая это, мы получим такой ответ:
T=100+273=373К
Ответ: 373 К.
В первом сосуде находится азот, во втором – водород. Чему равно отношение давления p1 азота к давлению p2 водорода при одинаковых значениях концентрации молекул и температуре?
Применим формулу связи давления газа p с концентрацией молекул n и абсолютной температурой T:
![]()
Тогда искомое отношение давлений азота p1 и водорода p2 можно найти так:

Поскольку в условии сказано, что концентрация и температура газов равны, то есть
![]()
значит:

Ответ: 1.
Какой объем при нормальных условиях занимают 5 г углекислого газа?
Эту задачу проще всего решить, если воспользоваться уравнением Клапейрона-Менделеева:

Выразим из уравнения искомый объем V:

Здесь R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К). Нормальным условиям соответствует давление p, равное 100 кПа, и температура T, равная 0° C или 273 К. Молярная масса углекислого газа (CO2) равна 0,044 кг/моль. Переведем массу в систему СИ и посчитаем ответ:

Интереса ради представим формулу (1) в следующем виде, где ν – это количество вещества:

Из формулы видно, что равные количества вещества любых газов при нормальных условиях занимают один и тот же объем.
Ответ: 0,0026 м3.
В сосуде вместимостью 2 м3 находится 2,4 кг газа. Под каким давлением находится газ, если средняя квадратичная скорость его молекул равна 500 м/с?
Запишем основное уравнение молекулярно-кинетической теории (МКТ) идеального газа:

Также запишем формулу определения концентрации молекул газа n (это отношение количества молекул N к объему газа V):

Полученное подставим в формулу (1), тогда:
![]()
Заметьте, что произведение массы одной молекулы m0 на число молекул N равно массе газа m:

Посчитаем ответ:

Ответ: 0,1 МПа.
Чему равна температура газа, если при концентрации 2,65·1025 м-3 он создает давление 98,8 кПа?
Воспользуемся формулой связи давления p с концентрацией молекул n и абсолютной температурой газа T:
![]()
В этой формуле k – это постоянная Больцмана, равная 1,38·10-23 Дж/К. Из этой формулы выразим искомую температуру T:

Посчитаем численный ответ задачи:

Ответ: -3°C.
Плотность газа в баллоне электрической лампы 0,9 кг/м3, давление при горении 110 кПа. Вычислить среднюю квадратичную скорость молекул газа.
Основное уравнение молекулярно-кинетической теории (МКТ) идеального газа записывается так:

Распишем в этой формуле концентрацию nn как отношение количества молекул N к объему газа V:

Произведение массы одной молекулы m0 на число молекул N дает массу газа m, поэтому:

Отношение массы газа m к объему газа V – это плотность газа ρ, значит:

Выразим искомую среднеквадратичную скорость υкв:

Посчитаем численный ответ к задаче:

Ответ: 2180 км/ч.
Определить число молекул, содержащихся в 1 г воды.
В одном моле любого вещества содержится одинаковое число молекул, равное числу Авогадро NА. Поэтому, чтобы определить число молекул N, нужно количество вещества νν умножить на число Авогадро NА, т.е. применить такую формулу:
![]()
Число Авогадро NА равно 6,022·1023 1/моль (это физическая постоянная). Количество вещества легко определить по формуле:

Здесь M – это молярная масса воды, равная 0,018 кг/моль. Итоговая формула примет вид:

Переведем массу воды mm в систему СИ:

Произведем вычисления:

Ответ: 3,35·1022.
При какой температуре находится одноатомный газ, если средняя кинетическая энергия его молекулы равна 8·10-20 Дж?
Среднюю кинетическую энергию поступательного движения молекулы одноатомного газа Eк можно определить по такой формуле:
![]()
В этой формуле k – постоянная Больцмана, равная 1,38·10-23 Дж/К. Выразим из формулы искомую температуру T:

Произведем вычисления:

Ответ: 3865 К.
Определить количество вещества, содержащегося в медной отливке массой 96 кг.
Чтобы определить количество вещества ν, нужно найти отношение массы вещества m к молярной массе вещества M.
![]()
Молярная масса меди (Cu) равна 0,064 кг/моль. Посчитаем ответ:

Ответ: 1500 моль.
Под каким давлением находится кислород в баллоне, если при температуре 27° C его плотность 6,44 кг/м3?
Запишем уравнение Клапейрона-Менделеева:
![]()
Поделим обе части уравнения на объем газа V, получим:

Тогда в правой части имеем отношение массы газа m к его объему V, что равно плотности ρ:

Молярная масса кислорода O2 M равна 0,032 кг/моль, универсальная газовая постоянная R – 8,31 Дж/(моль·К). Переведем температуру t в Кельвины и посчитаем ответ:

Ответ: 500 кПа.
В комнате размером 4x5x2,7 м3 испарился кристаллик йода массой 20 мг. Сколько молекул йода оказалось в 1 см3 воздуха комнаты при условии их равномерного распределения? Молярная масса йода равна 127 г/моль.
В случае равномерного распределения молекул йода по объему комнаты число его молекул N0 в объеме V0 можно определить через концентрацию nn по формуле:
![]()
Концентрация молекул nn равна отношению количества всех молекул йода N к объему комнаты V:
![]()
Объем комнаты V легко найти как объем прямоугольного параллелепипеда:
V=abc
Число всех молекул N найдем как произведение количества вещества ν на число Авогадро NА:
![]()
Количество вещества νν равно отношению массу всего йода mm к молярной массе йода M. Учитывая, что молярная масса M молекулярного йода I2 в два раза больше молярной массы M0 атомарного йода I, указанной в условии, имеем:

В итоге, если подставить все приведенные формулы в формулу (1), получим:

Число Авогадро равно 6,022·1023 моль-1. Переведем некоторые величины в систему СИ:

Посчитаем численный ответ:

Ответ: 8,8·1011.
Найдите отношение средних скоростей молекул O2 и H2 при одинаковой температуре.
Вообще, среднюю квадратичную скорость молекул газа можно определить по формуле:
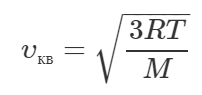
В этой формуле R – универсальная газовая постоянная, T – абсолютная температура газа, M – молярная масса газа. Из формулы видно, что скорость молекул газа тем больше, чем меньше его молярная масса. Тогда отношение скоростей молекул водорода к молекулам кислорода равно:

Так как по условию T1=T2, то:

Молярная масса водорода H2 M1 равна 0,002 кг/моль, кислорода O2 M2 равна 0,032 кг/моль. Посчитаем ответ:

Ответ: 4.
В лабораторных условиях создан высокий вакуум, то есть очень малое давление, равное 1,33 нПа. Сколько молекул остается при этом в 1 м3 газа? Температуру принять равной 293 К.
Вспомним формулу связи давления идеального газа pp с концентрацией его молекул nn и абсолютной температурой T:
![]()
Присутствующая в формуле постоянная Больцмана k равна 1,38·10-23 Дж/К. Концентрация nn равна отношению количества всех молекул газа N на объем V, который газ занимает:

Тогда формула (1) станет такой:

Откуда искомое число молекул N равно:

Число молекул газа N – это безразмерная величина.
Ответ: 3,3·1011.
Какова плотность сжатого воздуха при 0° C в камере шины автомобиля “Волга”? Давление 0,17 МПа.
Применим уравнение Клапейрона-Менделеева:

Поделим обе части уравнения на объем V, тогда получим:
![]()
Отношение массы m к объему V есть плотность газа ρ, заменив в правой части равенства это отношение на плотность, получим:

Теперь выразим искомую величину, в итоге имеем такую формулу:

Молярная масса воздуха MM равна 0,029 кг/моль. Заметьте, что её нельзя определить с помощью таблицы Менделеева, так как воздух – это смесь газов. Переведем температуру tt в шкалу Кельвина:
![]()
Посчитаем ответ:

Ответ: 2,17 мг/см3.
Определить молярную массу газа, если его плотность при нормальных условиях равна 0,09 кг/м3.
Запишем уравнение Клапейрона-Менделеева:

Плотность газа ρ, как и любого другого вещества, находят по формуле:
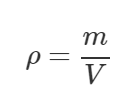
Тогда формула (1) примет следующий вид:

Выразим отсюда искомую молярную массу газа M:

Напомним, что при нормальных условиях давление pp равно 100 кПа, а температура T – 0° C или 273 К. Универсальная газовая постоянная равна 8,31 Дж/(моль·К). Считаем ответ:

По полученной молярной массе легко догадаться, что это водород H2.
Ответ: 2 г/моль.
Определить среднюю квадратичную скорость молекул азота при температуре 27° C?
Среднюю квадратичную скорость молекул идеального газа υквυкв определяют по такой формуле:

В этой формуле R – универсальная газовая постоянная, равная 8,31 Дж/(моль·К), M – молярная масса газа, равная у азота 0,028 кг/моль. Переведем данную в условии температуру из шкалы Цельсия в шкалу Кельвина:
![]()
Посчитаем ответ:

Ответ: 0,5 км/с.
Найти число молекул в 2 кг углекислого газа.
Число молекул N находят по следующей формуле:
![]()
В этой формуле ν – количество вещества, а NА – число Авогадро, равное 6,022·1023 моль-1. Количество вещества ν найдем по следующей известной формуле:

Молярная масса M углекислого газа (CO2) равна 0,044 кг/моль. В итоге Вы должны получить такую формулу:

Посчитаем численный ответ:

Ответ: 2,74·1025.
Определить плотность воздуха при нормальных условиях. Молярную массу принять равной 29 г/моль.
Нормальные условия (н.у) – это:
давление p, равное приближенно атмосферному, т.е. 100 кПа;
температура T, равная 0° C или 273 К.
Запишем уравнение Клапейрона-Менделеева:

В уравнении M – это молярная масса газа, в данном случае воздух. Поделим обе части уравнения на объем газа V:
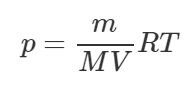
Отношение m\V в правой части есть плотность газа ρ, поэтому:
![]()
Откуда плотность воздуха ρ равна:

Переведем молярную массу газа в систему СИ:

Посчитаем ответ:

Ответ: 1,28 мг/см3.
Во сколько раз масса молекулы углекислого газа CO2 больше массы молекулы аммиака NH3?
В общем случае массу одной молекулы m можно найти по такой формуле:

В этой формуле M – молярная масса вещества (т.е. масса 1 моля вещества), а NА – число Авогадро (количество молекул в 1 моле любого вещества). Тогда отношение масс молекул углекислого газа и аммиака равно:

Молярная масса углекислого газа CO2 M1 равно 0,044 кг/моль, а аммиака NH3 M2 – 0,017 кг/моль. Таким образом, отношение масс молекул равно:

Ответ: 2,59.
За 20 суток из стакана полностью испарилась 0,2 кг воды. Сколько в среднем молекул вылетало с поверхности воды за 1 с?
Если скорость испарения, то есть количество молекул, вылетающее с поверхности воды за единицу времени, всегда постоянна, тогда справедливо следующее равенство:

Откуда получим:
![]()
Общее количество молекул воды N в массе m найдем по формуле:
![]()
Здесь NА – число Авогадро (оно равно 6,022·1023 моль-1), а ν – количество вещества, которое определяют по следующему выражению:
![]()
В этой формуле M – молярная масса воды, её легко определить по таблице Менделеева, зная химическую формулу вещества. Для воды (H2O) молярная масса равна 0,018 кг/моль. В итоге мы получим такую формулу:

Переведем время T, данное в сутках, в секунды:
![]()
Посчитаем ответ:

Ответ: 3,87·1018.
Считая, что диаметр молекул водорода составляет около 0,23 нм, подсчитать, какой длины получилась бы нить, если бы все молекулы, содержащиеся в 1 мг этого газа, были расположены в один ряд вплотную друг к другу.
Длину получившейся нити L можно найти, перемножив количество молекул водорода N на диаметр одной молекулы d:
![]()
Количество молекул N найдем по такой формуле:
![]()
Из последней формулы видно, что нам знать, какое количество вещества ν содержится в массе m. Это можно определить по формуле:

Молярная масса водорода (H2) M равна 0,002 кг/моль. Подставляя поочерёдно одно выражение в другое, Вы получите такую окончательную формулу:

Переведем массу m в систему СИ и посчитаем ответ:

Ответ: 69,25 Гм.
В сосуде находится газ под давлением 150 кПа при температуре 23° C. Найти концентрацию молекул.
Запишем формулу связи давления pp идеального газа с концентрацией молекул nn и абсолютной температурой T:
![]()
В этой формуле k – постоянная Больцмана, равная 1,38·10-23 Дж/К. Выразим из этой формулы искомую концентрацию n:
![]()
Обратите свое внимание, что в формуле фигурирует абсолютная температура, поэтому переведем данную в условии температуру в шкалу Кельвина:
23∘C=296К
Произведем вычисления:

Ответ: 3,67·1025 м-3.
Определить среднюю квадратичную скорость молекул водорода при нормальных условиях.
Решение задачи: Кинетическую энергию поступательного движения молекул газа можно определять по двум формулам:

Приравняем эти два выражения и выразим среднюю квадратичную скорость υкв:

Массу одной молекулы m0m0 можно узнать, если разделить молярную массу M на число Авогадро NА:

Молярная масса водорода (H2) равна 0,002 кг/моль. В таком случае формула (1) примет такой вид: э

Известно, что произведение двух постоянных – постоянной Больцмана k и числа Авогадро NА – дают в результате универсальную газовую постоянную R, равную 8,31 Дж/(моль·К). Таким образом, получим:

Нормальным условиям соответствует давление p, равное (приближенно) атмосферному, то есть 100 кПа, и температура T, равная 0° C или 273 К. Считаем ответ:

Ответ: 1,8 км/с.
Под каким давлением находится кислород в баллоне, если при температуре 27° C его плотность 6,24 кг/м3?
Применим уравнение Клапейрона-Менделеева:
![]()
Молярная масса кислорода (O2) MM равна 0,032 кг/моль. Разделим обе части уравнения на объем V:
![]()
Отношение массы m к объему V равно плотности газа ρ, поэтому:

Переведем температуру в абсолютную шкалу температур и посчитаем ответ:
27∘C=300К

Ответ: 0,49 МПа.
При какой температуре средняя квадратичная скорость молекул кислорода достигнет 600 м/с?
Среднюю квадратичную скорость молекул идеального газа υквυкв можно найти по такой формуле:

В этой формуле R – это универсальная газовая постоянная, равная 8,31 Дж/(моль·К), M – молярная масса газа, равная у кислорода 0,032 кг/моль. Выразим из формулы искомую температуру кислорода T:

Численно эта температура равна:

Ответ: 462,1 К.